近日,生命科学研究院引进人才王炜副研究员、博士后崔闻在重要先天免疫蛋白家族鸟苷酸结合蛋白(GBP)的结构与功能研究中取得重要突破,以并列第一作者身份于4月6日在国际著名学术期刊《Proceedings of the National Academy of Sciences of the United States of America》上发表题为“Structural Basis for GTP-induced Dimerization and Antiviral Function of Guanylate-binding Proteins”的研究论文。论文中报道了GBP5在激活前以及激活后两种状态下的三维空间结构,揭示了GBP家族发生激活变构的分子机制。

GBP家族成员是干扰素诱导表达的一类重要的先天免疫蛋白,广泛参与宿主对病毒(HIV-1病毒、流感病毒、丙型肝炎病毒和卡波西氏肉瘤病毒等),细菌(结核分枝杆菌、军团菌以及福式志贺菌)以及原生动物(弓形虫)的免疫反应。此外,GBP家族蛋白还参与炎症信号通路的调控,是免疫系统的“枢纽”。因此,揭示GBP家族蛋白被GTP(信号分子)激活的分子机制,对深入认知免疫系统的工作机理以及开发新型抗感染治疗手段显得尤为重要。
为了探究GBP家族成员被激活的精确分子机制,崔闻、王炜等研究人员历时五年时间,率先在国际上解析了GBP5近全长分子在激活前、后的三维空间结构。结果显示,结合GTP后,两个GBP5分子会发生“头对头”的结合。头部的“碰撞”会进一步诱导两个GBP5分子的尾部分别发生较大角度偏转,从而相互靠近、交叉并在末端形成另一个“脚并脚”的结合界面。该激活过程完全不同于以前学界所了解的“敞开式”激活模型(Ghosh et al., Nature, 2006),而完全呈现出一个“闭合式”的激活模型。在此基础上,研究小组通过抗HIV 病毒实验、溶液状态的小角散射等多学科交叉实验,证实该激活模型对GBP家族的多个成员普遍适用。
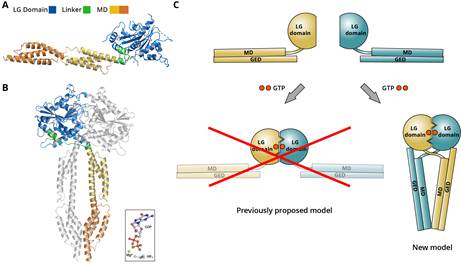
(A)GBP5激活前的三维空间结构;(B)GBP5激活后的三维空间结构;
(C)GBP蛋白的激活变构机制
此项研究工作首次描绘了精确的GBP蛋白激活变构的分子机制,彻底纠正了领域内十余年间对GBP激活机制的认识上的误区,为进一步深入理解GBP蛋白家族在先天免疫中发挥的重要功能奠定了理论基础。
本项工作由重庆医科大学、天津大学、上海科技大学、德国乌尔姆大学、中山大学、耶鲁大学和南京大学等多个单位合作完成。晶体衍射数据收集得到上海同步辐射光源和国家蛋白质(上海)设施的帮助。本项研究得到了科技部国家重点基础研究发展计划、国家自然科学基金以及天津市杰出青年科学基金等项目的支持。
原文链接:https://www.pnas.org/content/118/15/e2022269118















